KELIMPAHAN UNSUR-UNSUR DI ALAM
1.Keberadaan Unsur-unsur di Kulit Bumi
Sekitar 90 jenis unsur terdapat di alam, sisanya merupakan unsur buatan. Sebagian dari unsur tersebut terdapat sebagian unsur bebas, tetapi lebih banyak yang merupakan senyawa. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) terdapat sebagai unsur bebas. Unsur-unsur logam pun, yaitu emas, platina, perak, dan tembaga, juga ditemukan sebagai bentuk bebas.
2. Kelimpahan Unsur-unsur di Kulit Bumi
Unsur yang memlimpah di Bumi dapat diilustrasikan sebagai beikut.
Komposisi udara bersih dan kering
Rumus beberapa mineral
SIFAT-SIFAT UNSUR
Kita membedakan sifat-sifat zat atas sifat fisis dan sifat kimia. Sifat fisis menyangkut penampilan (seperti wujud, kekerasan,warna,bau, dan rasa), serta sifat-sifat yang tidak melibatkan pengubahan zat itu menjadi zat lain (seperti jari-jari atom, titik leleh,titik didih, dan kalor jenis). Sifat kimia berkaitan dengan reaksi yang dapat dialami oleh zat itu, seperti : kereaktifan, daya oksidasi, daya reduksi, sifat asam, dan basa. Berikut merupakan sifat-sifat unsur baik menurut golongan maupun periode.
1. Gas Mulia
Gas mulia adalah unsur golongan VIII A. Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi). tidak ditemukan satupun senyawa alami dari gas mulia.
a. Sifat-Sifat fisis gas mulia
b. Sifat_sifat kimia gas mulia
Kereaktifan gas mulia bertambah besar sesuai dengan pertambahan jari-jari atomnya, yaitu dari atas kebawah. Pertambahan jari-jari atom mengakibatkan daya tarik inti terhadap elektron kulit terluar berkurang, sehingga elektronnya semakin mudah ditarik oleh atom lain.
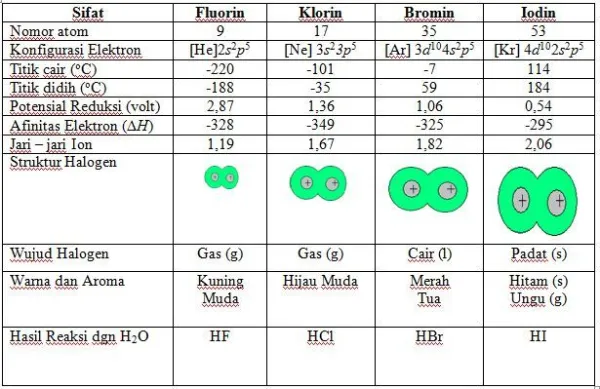
2. Halogen
Unsur-unsur golongan VII A disebut Halogen. Dunamai demikian karena unsur tersebut dapat bereaksi dengan logam membentuk garam. Unsur halogen mempunyai 7 elektron valensi pada subkulit ns np.
a. Sifat-sifat fisis
1. Struktur halogen
dalam bentuk unsur, Halogen (X) terdapat sebagai molekul diatomik (X2).
2. Wujud Halogen
misalkan Iodin padat pada tekanan atmosfer tidak membuat unsur itu meleleh, tetapi langsung menguap (menyublim).
3. Warna dan aroma Halogen
Halogen mempunyai warna dan aroma tertentu. Florin berwarna kuning muda, klorin berwarna Hijau muda, bromin berwarna merah tua, Iodin padat berwarna hitam, sedangkan uap Iodin berwarna ungu.
4. Kelarutan halogen
kelarutan dalam air berkurang dari fluorin ke iodin. Fluorin tidak sekedar larut dalam air, tetapi segera bereaksi membentuk HF dan O2. Iodin praktis tidak reaktif dengan air. halogen bersifat nonpolar, oleh karena itu ia mudah larut dalam pelarut nonpolar seperti karbon tetraklorida atau kloroform.
b. Sifat-sifat Kimia
1. Kereaktifan Halogen
Halogen merupakan kelompok unsur nonlogam yang paling reaktif.
2. Reaksi halogen
a. Reaksi dengan logam
Halogen bereaksi dengan sebagian besar logam menghasilkan halida logam dengan bilangan oksidasi tertinggi.
b. Reaksi dengan Hidrogen
Semua halogen bereaksi dengan hidrogen membentuk Hidrogen halida (HX).
c. Reaksi dengan nonlogam dam metaloid tertentu.
halogen bereaksi dengan sejumlah nonlogam dan metaloid..
d. Reaksi dengan air
Fluorin bereaksi hebat dalam air membentuk HF dan membebaskan oksigen. Halogen yang lainnya mengalami reaksi disproporsionasi.
e. Reaksi dengan basa
Klorin, Bromin, dan iodin mengalami disproporsionasi dalam basa.
f. Reaksi antarhalogen
Antarhalogen dapat bereaksi membentuk senyawa antarhalogen.
3. Daya oksidasi Halogen
Halogen merupakan pengoksidasi kuat. Daya pengoksidasi halogen menurun dari atas ke bawah pada sistem periodik unsur, yaitu dari fluorin ke iodin.
3. Logam alkali
Logam alkali adalah unsur-unsur golongan IA (kecuali hidrogen), yaitu litium, natrium, kalium, rubidium, sesium, dan fransium.
a. Sifat Fisis
b. Sifat kimia
Logam alkali merupakan golongan logam yang paling kreatif. Hampir semua senyawa logam alkali bersifat ionik dan mudah larut dalam air.
Reaksi-reaksi logam alkali
1. Reaksi dengan air
semua logam alkali beraksi dengan air membentuk basa dan gas hidrogen.
2. Reaksi dengan Hidrogen
Jika dipanaskan, logam alkali dapat bereaksi dengan gas hidrogen membentuk hidrida.
3. Reaksi dengan Oksigen
Logam alkali terbakar dalam oksigen membentuk oksida, peroksida, atau superoksida.
4. Reaksi dengan halogen
Logam alkali bereaksi hebat dengan halogen membentuk garam halida.
4. Logam Alkali Tanah
Logam alkali tanah meliputi berilium, magnesium, kalsium, stronnsium, barium, dan radium. Dalam sistem periodik, keenam unsur itu terletak pada golongan IIA.
a. Sifat-sifat fisis logam alkali tanah
b. Sifat-sifat kimia logam alkali tanah
Sifat kimia logam alkali tanah mirip dengan logam alkali, tetapi logam alkali tanah kurang reaktif dari logam seperiode. Hal itu disebabkan jari-jari atom logam alkali tanah lebih kecil, sehingga energi pengionan lebih besar.
1) Reaksi dengan air
Kalsium, stronsium, dan bariumbereaksi baik dengan air membentuk basa dan gas hidrogen.
2) Reaksi dengan udara
Semua logam alkali tanah terkorosi terus-menerus di udara membentuk oksida, hidroksida, kecuali berilium dan magnesium.
3) Reaksi dengan halogen
Semua logam alkali tanah bereaksi dengan halogen membentuk garam halida.
4) Reaksi dengan asam dan basa
Semua logam alkali tanah bereaksi denagn asam kuat (seperti HCL) membentuk garam dan gas hidrogen.
c. Reaksi nyala logam alkali dan alkali tanah
Salah satu ciri khas dari suatu unsur adalah spektrum emisisnya. Unsur yang tereksitasi, karena pemanasan ataupun karena sebab lainnya, memancarkan radiasi elektromagnetik yang disebut dpektrum emisi. Berikut merupakan warna nyala logam alkali,
D. Kelarutan senyawa logam alkali tanah
Senyawa logam alkali pada umumnya mudah larut dalam air, sedangkan senyawa logam alkali tanah banyak yang suka larut.
PEMBUATAN BEBERAPA UNSUR DAN SENYAWANYA
1. Natrium
Di antara logam alkali, natrium merupakan logam yang paling banyak penggunaannya, baik sebagai unsur maupun senyawa. Natrium dibuat dari elektrolisis lelehan natrium klorida yang di campur dengan kalsium klorida (sel downs). kalsium klorida berguna untuk menurunkan titik cair ( dengan cara itu titik leleh dapat diturunkan dari 801 derajat C menjadi sekitar 500 derajat C)
2. Magnesium
Magnesium dibuat dari air laut melalui tahap-tahap. mula-mula air laut dicampur dengan kapur (CaO) sehingga magnesium mengendap sebagai magnesium hidroksida (Mg(OH)2). Adapun CaO dibuat dari batu kapur atau kulit kerang melalui pemanasan. pembuatan natrium, pembuatan magnesium juga dilakukan melalui elektrolisis lelehan garam kloridanya. endapan magnesium hidroksida yang terbentuk, disaring kemudian di reaksikan dengan larutan asam klorida pekat. Selanjutnya, larutan di uapkan sehingga di peroleh kristal magnesium klorida (MgCl2). kristal itu kemudian di cairkan dan di elektrolisis.
3. Alumunium
Pengolahan alumunium dari bauksit berlangsung dalam 2 tahap. Tahap pertama pemurnian bauksit sehingga di peroleh alumunium oksida murni (Alumina). Tahap kedua adalah peleburan (Reduksi) alumina. Pengolahan alumunium oksida dari bauksit di dasarkan pada sifat omfoter dari oksida alumunium itu. pengotor utama dari bauksit biasanya terdiri atas SiO2, Fe2O3, dan, TiO2. Apabila bauksit dilarutkan dalam larutan natrium hidroksida, maka alumunium oksida akan larut sedangkan pengotornya tidak. Pengotor di pisahkan dengan penyaringan. Selanjutnya, alumunium di endapkan dari filtrat dengan mengalirkan gas karbondioksida dan pengenceran. Endapan alumunium hidroksida di saring, dikeringkan lalu di panaskan sehingga di peroleh alumunium oksida murni (Alumina). Selanjutnya, pada tahap kedua reduksi alumunium oksida dilakukan melalui elektrolisis menurut proses Hall-Heroult
4. Besi
Besi diolah dari bijihnya dalam suatu tungku yang disebut Tanur tiup (blast furnace), Tanur tiup berbentuk silinder raksasa dengan tinggi 30 m atau lebih dan diameter bagian tengah sekitar 8 meter. Bahan yang digunakan dalam pengolahan besi, selain bijih besi adalah kokas (C) dan batu kapur (CaCO3). Kokas berfungsi sebagai reduktor, sedangkan batu kapur berfungsi sebagai fluks, yaitu bahan yang akan bereaksi dengan pengotor dalam bijih besi dan memisahkan pengotor itu dalam bentuk cairan kental yang disebut terak (slag). Komposisi bahan-bahan tersebut bergantung pada pengotor dalam bijih besi. Bijih besi mengandung pengotor, baik yang besifat asam seperti SiO2 (pasir), Al2O3, dan P2O5, maupun pengotor yang bersifat basa seperti CaO, MgO dan MnO. Akan tetapi, biasanya pengotor yang bersifat asam lebih banyak sehingga perlu di tambahkan fluks yang besifat basa, yaitu CaCO3.
5. Tembaga
Bijih tembaga yang terpenting adalah kalkopirit (CuFeS2) adanya besi dalam bijih tembaga membuat proses pengolahan tembaga menjadi relatif sulit. Pengolahan tembaga melalui beberapa tahap, yaitu, flotasi, pemanggagan, peleburan, pengubahan, dan elektrolisis. Bijih tembaga hanya mengandung 0,5% Cu, melalui pengapungan dapat diperoleh biji pekat yang mengandung 20-40% Cu. Bijih pekat tersebut kemudan dipanggang untuk mengubah besi sulfida menjadi besi oksida, sedangkan tembaga tetap berupa sulfidian. Biji yang sudah melalui pemanggangan kemudian dilembur sehingga bahan tersebut mencair dan terpisah menjadi dua lapisan.
6. Intan
Intan merupakan zat yang paling keras, strukutur atom intan sangatlah rumit dan panjang, jadi satu butir intan saja merupakan molekul raksasa. Intan adalah senyawa alami yang ada di alam, namun intan buatan biasanya terbuat dari grafit yang dipanaskan pada suhu sekitar 3.300'C dan tekanan sekitar 125.000 atm
7. Karbon Dioksida
Karbon dioksida adalah senyawa yang tidak beracun, namun jika terlalu banyak maka bisa mengganggu sistem pernapasa, Karbon dioksida terdapat di udara dengan kadar sekitar 0,0035% . Juga terdapat dalam air utama air laut, Karbon dioksida komersial diperoleh dari pembakaran residu penyulingan minyak bumi. Dalam jumlah besar juga diperoleh sebagai hasil dari pembuatan alkohol dan proses peragian
8. Silikon
Silikon meruapakan senyawa paling muda ditemukan bumi biasanya berbentuk silika, dan silikat.
Silikon dibuat dari silika dengan kokas sebagai reduktor. Campuran silika dan kokas dipanaskan dalam suatu tanur listrik pada suhu sekitar 3.000'C.
Pembuatan silikon ultra murni mula-mula silikon biasanya direaksikan dengan klorin sehingga terbentuk silikon tetraklorida, kemudian dimirnikan dengan destilasi bertingkat, selanjutnya silikon tetraklorida direduksi dengan mengalirkan campuran uap silikon tetraklorida dengan gas dihidrogen melalui suatu tabung yang dipanaskan. Dengan cara ini dapat diperoleh silikon ultra murni.
9. Nitrogen
Nitrogen merupakan senyawa yang mendominasi 78% dari volume udara. Akan tetapi, kelimpahan nitrogen di kulit bumi hanya 0,03%. Nitrogen tidak berwarna, tidak berbau, dan tidak berasa .
Dalam industri diperoleh dari pencairan udara, dan distilasi bertingkat udara cair. Pencairan udara dilakukan seperti gambar di bawah ini
10. Amona
Gas amonia berbau khas dan sangat menyengat. Amonia dibuat dari gas nitrogen dan hidrogen menurut proses Haber-Bosch. Reaksi dilangsungkan pada suhu sekitar 550'C dan tekanan yang sangat tinggi, dengan katalis besi denga Al2O3, Mg, CaO, dan K20.
Di laboratorium , amonia dapat dibuat melalui garam amonium dengan basa kuat.
11. Fosforus
Fosforus mempunyai dua bentuk alotropi, yaitu fosforus putih, dan fosforus merah. Fosforus putih lebig reaktif daripada fosforus merah dan bersifat racun.
Fosforus dapat dibuat dengan memisahkan senyawa fosfat daro senyawa yang kompleks flourapit, kemudian dipanaskan dengan pasir silikon dan kokas, kemudian uap fosforus disimpan di dalam air .
12. Oksigen
Oksigen adalah unsur yang kita butuhkan untuk proses respirasi. Energi dari respirasi digunakan untuk mempertahankan aktivitas tubuh.
Oksigen adalah unsur alam yang sangat melimpah. namun oksigen dapat dibuat di laboratorium dengan penguraian kalium klorat, penguraian hidrogen peroksida, dan elektrolisis air.
13. Belerang
Belerang banyak terdapat di kulit bumi, sebagai unsur maupun senyawa.
Belerang dapat di buat melalui cara Frasch seperti gambar di bawah ini
namun pada saat ini belerang di buat melalui Desulfurisasi minyak bumi dilakukan untuk melakukan pencemeran akibat pembakaran belerang.
14. Halogen
a. Flourin biasanya bernama freon, freon terdapat pada pendingin mesin seperti AC dan lemari es.
b. Klorin adalah halogen yang sering sekali dipakai, klorin berguna untuk pembuatan industri plastik, dan karet sintesis.
c. Iodin usur ini digunakan untuk obat-obatan.
Pembuatan klorin melalui reaksi kapur-klor dengan asam sulfat, oksidasi Cl- dengan suatu oksidator kuat.
DAMPAK PENGGUNAAN BEBERAPA UNSUR
1. Natrium
Unsur ini memang sangat di butuhkan oleh tubuh untuk tetap menjaga kesehatan. Akibat
kekurangan natrium dapat menyebabkan penyakit yang bernama Hiponatremia. Penyakit ini mengacu pada kadar natrium serum yang jumlahnya kurang normal.
Biasanya natrium yang ada pada dalam tubuh keluar bersamaan dalam bentuk muntah, berkeringan, diare, fristula, dan semua yang berhubungan denga diuretic, kegitan diet yang mengakibatkan seseorang BAB secara terus menerus dan juga karena terlalu sering mengkonsumsi garam terus menerus.
2. Magnesium
Pada tubuh manusia mengandung 25g magnesium, dimana 60% hadir dalam tulang dan 40% hadir dalam otot dan jaringan lain. Ini merupakan mineral makanan bagi manusia, salah satu mikro yang berfungsi bagi kesehatan manusia, yang bertanggung jawab pada membran dalam tubuh manusia: transmisi saraf, stimulan, kontraksi otot, kotruksi protein dan replika DNA.
Sejauh ini tidak ada kasus dalam keracunan magnesium. Pada dosis besar menggunakan magnesium oral hanya akan menyebabkan muntah dan diare saja. Dosis besar dalam penggunaan obat-obatan dan suplemen manusia dapat mnyebabkan berkurangnya otot, saraf, depresi, dan perubahan kepribadian.
3. Alumunium
Terlalu banyak mengonsumsi alumunium memberikan dampak NEGATIVE bagi tubuh, alumunium dapat merusak otak Alzheimer, kerusakan DNA, disfungsi ginjal, bahkan dapat mengakibatkan kanker payudara.
4. Besi
Selain mempunyai banyak manfaat besi juga dapat membahayakan manusia setelah besi iyu berkarat, misalya setelah kita tertusuk besi yang sudah berkarat kita dapan terjangkit penyakit tetanus. Zat besi juga dapat menyebabkan keracunan jika di konsumsi terlalu banyak
5. Tembaga
Batas magnesium logam tembaga dalam air adalah 1 bpj. Air yang memiliki tembaga melebihi kadar maksimum, dapat mengakibatkan kerongkongan terasa kering, mual-mual, diare terus -menerus, da iritas pada lambung.
6. Timah, Kromium, dan Emas











0 comments:
Post a Comment